ALCANOS
Los alcanos tienen baja reactividad, la más baja entre los
compuestos orgánicos.
• CnH2n+2 es la fórmula general de los hidrocarburos.
• Solo presentan enlaces
• Si solo se diferencia en una unidad de -CH2- son
compuestos de una serie homóloga.
• Pueden tener múltiples isómeros estructurales.
Alcanos, en los cuales, los carbonos se enlazan de manera
continua ( sin ramificaciones) se denominan alcanos de cadena lineal.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/alcanos/alcanos-lineales.gif |
La familia de alcanos lineales es un ejemplo de serie
homóloga. Serie homóloga de compuestos es una en la cual sucesivos miembros
difieren en un grupo metileno (CH2). La fórmula general para alcanos homólogos
es CH3(CH2) nCH3. Propano (CH3CH2CH3, con n=1) y butano (CH3CH2CH2CH3, con n=2)
son homólogos.
En una serie homóloga las propiedades físicas varían de forma continua tanto los puntos de fusión como los de ebullición van aumentando a medida que aumenta el número de carbonos de la molécula.
Alcanos con ramificaciones se denominan alcanos de cadena ramificada.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/alcanos/alcanos-ramificados.gif |
Nomenclatura de los alcanos
La ciencia química fue avanzando y el gran número de
compuestos orgánicos descubiertos hicieron imprescindible el uso de una
nomenclatura sistemática.
En el sistema IUPAC de nomenclatura un nombre está formado por tres partes: prefijos, principal y sufijos; Los prefijos indican los sustituyentes de la molécula; el sufijo indica el grupo funcional de la molécula; y la parte principal el número de carbonos que posee. Los alcanos se pueden nombrar siguiendo siete etapas:
Regla 1.- Determinar el número de carbonos de la cadena más
larga, llamada caden principal del alcano. Obsérvese en las figuras que no
siempre es la cadena horizontal.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/nomenclatura/nomenclatura-alcanos-cadena-principal.gif |
Regla 2.- Los sustituyentes se nombran cambiando la
terminación –ano del alcano del cual derivan por –ilo (metilo, etilo, propilo,
butilo). En el nombre del alcano, los sustituyentes preceden al nombre de la
cadena principal y se acompañan de un localizador que indica su posición dentro
de la cadena principal. La numeración de la cadena principal se realiza de modo
que al sustituyente se le asigne el localizador más bajo posible.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/nomenclatura/nomenclatura-alcanos-sustituyentes-01.gif |
Regla 3.- Si tenemos varios sustituyentes se ordenan alfabéticamente precedidos por lo localizadores. La numeración de la cadena principal se realiza para que los sustituyentes en conjunto tomen los menores localizadores.
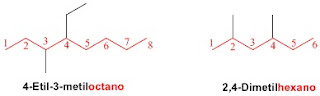 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/nomenclatura/nomenclatura-alcanos-sustituyentes-02.gif |
Regla 4.- Si al numerar la cadena principal por ambos
extremos, nos encontramos a la misma distancia con los primeros sustituyentes,
nos fijamos en los demás sustituyentes y numeramos para que tomen los menores
localizadores.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/nomenclatura/nomenclatura-alcanos-sustituyentes-04.gif |
Regla 5.- Si al numerar en ambas direcciones se obtienen los mismos localizadores, se asigna el localizador más bajo al sustituyente que va primero en el orden alfabético.
Regla 6.- Si dos a más cadenas tienen igual longitud, se toma como principal la que tiene mayor número de sustituyentes.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/nomenclatura/nomenclatura-alcanos-regla-6.gif |
Regla 7.- Existen algunos sustituyentes con nombres comunes
aceptados por la IUPAC, aunque se recomienda el uso de la nomenclatura
sistemática.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/nomenclatura/nomenclatura-alcanos-regla-7.gif |
PROPIEDADES FISICAS DE LOS ALCANOS
Los
alcanos son compuestos con hibridación sp3 en todos sus carbonos. Los cuatro sustituyentes
que parten de cada carbono se disponen hacia los vértices un tetraedro.
Las
distancias y ángulos de enlace se muestran en los siguientes modelos.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/propiedades-fisicas/propiedades-metano-etano-propano.gif |
Los
alcanos de menor tamaño, metano, etano, propano y butano son gases a
temperatura ambiente. Los alcanos lineales desde C5H12 hasta C17H36 son
líquidos. Alcanos de y mayor número de carbonos son sólidos a temperatura
ambiente.
Los
puntos de fusión y ebullición de los alcanos aumentan con el número de carbonos
de la molécula. También se observa que los alcanos ramificados presentan un
punto de ebullición menor que sus isómeros lineales.
En
la siguiente gráfica se representan los puntos de ebullición de alcanos
lineales (en negro) y los correspondientes a sus 2-metilalcanos isómeros (en
azul).
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/propiedades-fisicas/puntos-ebullicion.png |
En
fase líquida existen fuerzas de atracción entre moléculas que las mantiene
unidas. Para pasar a fase gas la sustancia es necesario vencer estas fuerzas
intermoleculares mediante el aporte de energía.
 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/propiedades-fisicas/van-der-waals.gif |
En moléculas neutras, como son los alcanos, las fuerzas atractivas son debidas a interacciones de van der Waals que pueden ser de tres tipos: interacciones dipolo – dipolo, dipolo – dipolo inducido y dipolo inducido – dipolo inducido.
La
formación de los dipolos inducidos que producen la atracción entre moléculas
neutras puede verse en el siguiente esquema:
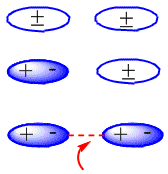 |
| https://www.quimicaorganica.org/images/stories/organica-i/alcanos/propiedades-fisicas/formacion-dipolos.gif |
Consideremos
los isómeros del pentano, como ejemplo de la disminución en el punto de
ebullición, al pasar de alcanos lineales a ramificados.
El
pentano tiene una importante área superficial que permite gran número de
interacciones dipolo inducido – dipolo inducido. El 2-Metilbutano es más
compacto y posee menor área superficial, menos interacciones intermoleculares y
menor punto de ebullición.
Comentarios
Publicar un comentario
Gracias por participar